細胞培養
PHHは、Thermo Scientific Inc.(Waltham、MA、USA)から購入し、製造業者のプロトコルに従ってHepatocyte Medium(Thermo Scientific Inc.)を使用して培養した。 PHHを播種後3日以内に実験に使用した。
HLCの生成
STEMPRO人間ADSCはLife Technologies(日本東京)から購入しました。 私たちのHLC生成プロトコルが報告されました1。 ADSCは2〜6段階の実験に使用されました。 簡単に言えば、ADSC(2×106 ウェルあたり)を6ウェル平底コラーゲンコーティングプレート(Nunclon Sphera Microplates, Thermo Scientific Inc.)に播種し、F-12サプリメント(DMEM/F-12)を含む無血清Dulbecco’s Modified Eagle’s培地と共に24時間インキュベートするしました。 時間。 その後、3段階分化プロトコルが実行されました。 最初の段階では、完全な内胚葉分化を誘導するために、0.5mg/mのウシ血清アルブミン画分V(BSA; Sigma-Aldrich, St. Louis, MO, USA)および2μmol/Lを含有するDMEM/F- 12とインキュベートした。 Chir99021(グリコーゲンシンターゼキナーゼ3阻害剤、Selleckchem、東京、日本)24時間。 翌日、1%インスリン – トランスフェリン – セレン(ITS、Sigma-Aldrich)を培地に添加した。 第二段階では、0.5mg/mL BSA、1% ITS、20ng/mL骨形成タンパク質2(PeproTech)を含む非必須アミノ酸(Thermo Scientific Inc.)を含む最小必須培地(PeproTech) )にバッジを変更しました。 , Inc. NJ、USA)および30ng / mL線維芽細胞成長因子4(PeproTech、Inc.)を添加して5日間培養を続けた。 第三段階では、肝細胞分化誘導のために肝細胞成長因子(PeproTech, Inc.)20ng/mLを5日間処理した後、肝細胞成長因子20ng/mL、オンコスタチン(oncostatin)10ng/mLを処理した。 M(ペプロテック)および1×10-6 Mデキサメタゾン(Sigma-Aldrich)をさらに5日間服用します。
GLED調査
LED照射装置(3LH-256/3LH-75DPS、日本メディカル&ケミカルインスツルメンツ(株)、大阪日本)を用いて最大光強度で波長520nmのGLEDを作製した。 光強度を測定するために、光複写システム(Light analyzer LA-105、Nippon Medical&Chemical Instruments Co.、Ltd.)を使用した。 細胞培養プレートをLED照射装置の上に置き、エネルギー密度生成を21W/mに設定した。2。 第3段階(肝細胞分化段階)では、細胞を室温で5分間GLEDに曝露して、0.63J/cmの放射線曝露を提供した。2 毎日。 GLED照射プロトコルを図6に示す。 対照細胞は、GLED曝露がないことを除いて同じ方法で処理した。 処理中に培養液の温度が変化しないように十分な換気を提供した。 実験は、購入した3つのADSCを用いて同じ条件で少なくとも3回繰り返した。
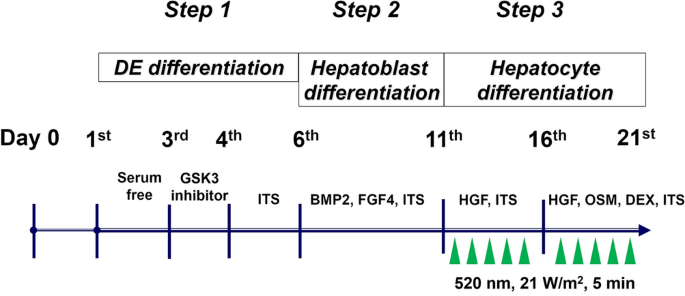
GLED調査 HLCの研究プロトコル GLEDは1日1回21W/m2で5分間照射された。2 肝細胞分化段階の10日間。 DE、最終内胚葉; GSK、グリコーゲン合成酵素キナーゼ。 ITS、インスリン – トランスフェリン – セレン。 BMP、骨形成タンパク質。 FGF、線維芽細胞成長因子。 HGF、肝細胞成長因子。 OSM、オンコスタチンM; DEX、デキサメタゾン。
細胞生存率
LIVE / DEAD細胞イメージングキット(Thermo Fisher Scientific、Inc.)を使用して、製造業者のプロトコルに従って21日目に、GLED処理および非処理HLC中で生きている/死んだ有核細胞を同定した。 蛍光シグナルは蛍光顕微鏡(Keyence Corporation)を用いて測定した。 Image Jソフトウェア(ver. 1.53, National Institutes of Health, Bethesda, MD, USA)を用いて細胞数を計算した。
フローサイトメトリーによるアポトーシスの検出
アポトーシスを検出するためにフローサイトメトリーを使用した。 照射された細胞と照射されていない細胞の両方が、製造元の指示(MBL International、Woburn、MA、USA)に従ってMEBCYTO Apoptosis Kitを使用して、アネキシンV結合フルオレセインイソチオシアネートおよびヨウ化プロピジウム(PI)で標識されました。 定量分析は、FACSVerse細胞計測器およびFACSiuteソフトウェア(Becton Dickinson、Franklin Lakes、NJ、USA)を用いて行った。
HLCのRT-PCR
製造元の指示に従って、RNeasy Mini Kit(Qiagen、Hilden、Germany)を使用して、各HLCサンプルから総RNAを調製した。 cDNAは、逆転写キット(Applied Biosystems、Foster City、CA、USA)を用いて合成した。 以下のTaqMan分析(分析識別番号およびプライマーを含む)を使用した:α-1抗トリプシン(AAT)(Hs00165475_m1)、アルブミン(ALB)(Hs00910225_m1)、OTC(Hs00166892_m1)、カルバミルリン酸合成Hs00157048_m1)、OPN3(Hs00173892_m1)およびPGC-1A(Hs00173304_m1)。 GAPDH(Hs02786624_g1)は、正規化のための安定したレベルの発現を有する内部対照として使用された(補足表1)。 全てのプライマーはThermo Fisher Scientific, Inc.から購入した。 データは2を用いて分析した。−ΔΔCt 方法。 相対発現レベルは ギャップDH 表現。 結果は、対照群と比較して、対応する群の相対的なmRNA発現の倍数変化として示される。
ウェスタンブロッティング
タンパク質抽出には、プロテアーゼ阻害剤カクテル(Sigma-Aldrich)とPhosSTOPホスファターゼ阻害剤カクテル(Roche、Tokyo、Japan)を含むRIPA緩衝液(Thermo Fisher Scientific、Inc.)を使用した。 総タンパク質濃度は、BCAキット(Thermo Fisher Scientific、Inc.)を用いて評価し、同量の抽出タンパク質を10%硫酸ナトリウムドデシル – ポリアクリルアミドゲル電気泳動ゲルから分離し、ポリビニリデンジフルオリド膜(Bio-Rad、Hercules、CA)に移しました。 、米国)。 タンパク質リッチを評価するために、ブロットを室温で1時間5%スキムミルクでブロックし、次の一次抗体と共に4℃で一晩インキュベートした:抗OPN3(1:1,000; SAB2700986; Sigma-Aldrich)および抗β-アクチン(1:1,000; カタログ番号4970; Cell Signaling Technology, Inc. MA, USA)。 次いで、ブロットを二次抗体である抗ウサギIgG、HRP連結(1:2,000、カタログ番号7074、Cell Signaling Technology, Inc.)と共に室温で1時間インキュベートした。 タンパク質は化学発光(GE、Little Chalfont、Buckinghamshire、UK)で検出された。
CYP3A4活性分析
CYP3A4酵素活性は、製造元の指示に従ってLuciferin-IPA(Promega Corporation、WI、USA)を使用したP450-Glo™CYP3A4アッセイを用いて評価した。 発光性は、マイクロプレートリーダー(SpectraMax i3; Molecular Devices, LLC)を用いて測定した。 発光測定は、生存細胞の総量に対して正規化した。
アンモニウム代謝分析
アンモニウム代謝は、塩化アンモニウム(NH)を添加した後、24時間目の細胞培養上清中のアンモニウムイオン濃度の変化として評価した。4氏)。 簡単に言えば、NH4培養プレートをHBSSで2回洗浄した後、Hanks’ Balanced Salt Solution(HBSS、FUJIFILM Wako Pure Chemical Corporation)を標準300μmol/Lに希釈したCl(FUJIFILM Wako Pure Chemical Corporation)を培養プレートに添加した。 プレートを同じインキュベーターに隣接して配置し、同じ条件でインキュベートした。 次に上清を回収し、アンモニア分析キット(Cell Biolabs)に適用し、NH後24時間間隔でアンモニウム濃度を測定した。4Clを追加。 対照群は標準アンモニア溶液のみを含む培養プレートであった。 参考値として上記と同様に肝細胞培地を含むPHHを用いてアンモニウム代謝分析を行った。
免疫蛍光染色
HLCをiPGell(日本東京のGeno社員)に固定化し、メーカーのプロトコルに従って4%パラホルムアルデヒドで固定しました。 凍結ゼリー化細胞を切片化し、ガラススライド上に置き、抗OPN3一次抗体(Abcam、ab140901)と共に4℃で一晩インキュベートした。 次に細胞を蛍光団結合二次抗体(Thermo Fisher Scientific Inc.、A11008)と共にインキュベートし、次いでDAPI(Thermo Fisher Scientific Inc.、P306931)と共にインキュベートした。 スライドを蛍光顕微鏡(Keyence Corporation、Itasca、IL、USA)で観察した。
カルシウム
2+とATP分析
細胞内カルシウム2+ GLED処理されたHLCの濃度はCaを用いて測定した。2+ 検出アッセイキット(Abcam、Cambridge、UK)。 簡単に言うと、細胞の均質化および4℃で5分間20,000×gで遠心分離した後、上清を回収した。 サンプルを発色試薬と混合し、製造元のプロトコルに従って室温で10分間インキュベートした。 各サンプルの吸光度値は、マイクロプレートリーダーを用いて575nmで測定した。 各細胞溶解物サンプルの測定は1×106 HLC。
GLEDを処理したHLCと未処理のHLCのATP量を評価するために、上記Caと同様に細胞均質化及び遠心分離を行った。2+ 分析およびアデノシン三リン酸(ATP)分析キット(FUJIFILM Wako Pure Chemical Corporation)を製造業者のプロトコルに従って使用した。 各細胞溶解物サンプルの測定は1×106 HLC。
活性酸素種(ROS)検出
ROS分析キット(Dojindo Lab.、Kumamoto、Japan)を用いて細胞内ROS形成を測定した。 簡単に言えば、分化日21日(GLED照射後10日)のHLCを6ウェル皿に播種し、2′,7′-ジクロロジヒドロフルオレセインジアセテート(DCFDA)と共に37℃で暗室で30分の間培養した。 HBSSで2回洗浄した後、製造業者のプロトコルに従って細胞を100μmol/Lの過酸化水素で30分間インキュベートした。 FACSVerse細胞測定器およびFACSiuteソフトウェア(Becton Dickinson)を用いて蛍光シグナルを測定および分析した。 蛍光顕微鏡(Keyence Corporation)を使用して細胞を画像化し、細胞蛍光レベルをImage Jソフトウェア用のCell Magic Wandプラグインを使用して測定した。
統計分析
全てのデータは平均±標準差として表される。 GraphPad Prism v7.0(GraphPad Software, Inc.)およびImage Jソフトウェアを用いて統計分析およびグラフ作成を行った。 Mann-Whitneyテストを使用して2つのグループ間の比較を分析した。 0.05未満(両側)のP値は統計的に有意であると見なされました。















+ There are no comments
Add yours