IgG-Fab用のIgGおよびFab部品の設計2 bsAb
我々は、IgG重鎖のN末端に融合されたintein-CとFabのCH1ドメインのC末端に融合されたintein-Nを設計してIgG-Fabを構築した。2 スプリットインテイン媒介ライゲーションによるbsAb分子(図1)。 このプロセスは、分割されたインテイン媒介PTS反応により、これら2つの部分を別々に発現、精製、および連結することができます(図1)。 この目的のために、抗体標識を含むいくつかのタンパク質工学用途に広く使用されているCfa DnaEスプリットインテインを選択しました。20 とbsAbの設定21。 抗CD3(M291)IgG22 そして抗Her2(トラスツズマブ)23 IgG-Fabを構築するためにFabを選択した。2。 抗Her2/抗CD3 bsAbは、乳がんの治療のための治療薬として人気のある構造の一つです。24、25,26。 VHH(Ia1;抗EGFR VHH)27 Cfa intein(Cfa)のintein-CのN末端に融合した。氏)表現を改善します。 Cfaインテインのインテイン-N(CfaN)をトラスツズマブFabのCH1ドメインのC末端に融合させた。
IgG-Fabに対するPTS反応2 (Her2/CD3)
CFA氏-IgG(抗CD3)およびFab-CfaN (anti-Her2)は哺乳動物細胞発現系によって発現され、CfaのプロテインAおよびNi-NTAカラムによって精製された。氏-IgGとFab-CfaN、それぞれ。 図2a、bは、タンパク質精製のSDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)画像を示す。 非還元SDS-PAGEは、溶出レーンで単一バンドとして示された両方の分子に対して鎖間二硫化結合が形成されたことを示した(Cfaの場合は182.6kDa)。氏– Fab-Cfaの場合、IgGおよび60.2 kDaN)。 精製したタンパク質を混合し、1:2モル比のCfaとPTS反応を行った。氏-IgGとFab-CfaN 2つの反応部位があるため、PTS反応の反応点は1:2モル比で混合して等モルになるからです。 抗Her2のVH-CH1と抗CD3の重鎖(73.7 kDa、図2cの赤い矢印)の連結生成物に対応する高分子量の新しいバンドが17時間後に現れる。 VHH-Cfaバンドの約50%氏-Hchain(図3aの黒い矢印)は、ライゲーション反応が進行したにもかかわらず、24時間反応後も残ります。 バンドは、CfaのC末端側で切断された重鎖に対応する。氏 不完全な反応に加えて、PTS反応の副反応も観察されたからである。 これらの望ましくない副反応は、分割インテイン媒介PTS反応においてしばしば観察された。 低反応収率および側方切断反応の原因因子を確認するためにインテイン反応部位周辺の配列を調べ、CfaのC末端側エクステン部分でグリコシル化可能性のある部位を明らかにした。氏 (図3a)。 NheIクローニング部位は、VH遺伝子(抗CD3)の直前に「~AS~」配列を導入し、N連結グリコシル化コンセンサス配列であるAsn-X-Ser/Thrが形成された。28。 したがって、我々は、Ser部分における可能なN-連結グリコシル化は、低い反応収率および側方切断反応を引き起こしたと推測した。
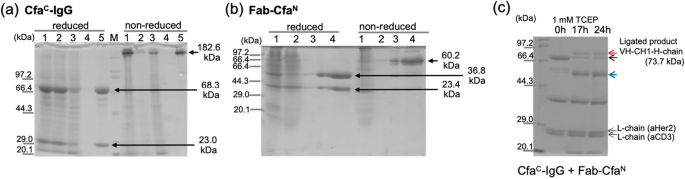
Cfaの発現、精製、連結氏-IgGとFab-CfaN。 (ㅏ)、そして(雨)Cfa精製のための還元および非還元SDS-PAGE氏-IgGとFab-CfaN Protein A カラムを使用します。 (ㅏ)1:培地、2:プレカラム、3:灌流、4:洗浄、5:溶出。 M:メーカーです。 (雨)1:プレカラム、2:通過液、3:洗浄、4:溶出。 M:分子量メーカー。 (氏)Cfa間のPTS反応のSDS-PAGE結果氏-IgGとFab-CfaN。 上部の黒い矢印は反応しないCfaを示します。氏-重い鎖。 赤い矢印は、連結された製品(VH-CH1-Hチェーン)のバンドを示します。 青い矢印は、CfaのC末端側で制御されていない切断によって生成された重鎖を示します。氏。

Cfaの発現、精製、連結氏-IgG-ΔS。 (ㅏ)VHH-Cfaの重鎖ドメインの順序氏-HchainおよびVHH-Cfa氏-Hchain-ΔS。 Cfa間のアミノ酸配列氏 とVHが表示されます。 (雨)Cfa精製のための還元および非還元SDS-PAGE氏– Ni-NTAカラムを使用したIgG-ΔS。 1:プレカラム、2:通過液、3:洗浄、4:溶出。 M:分子量メーカー。 (氏)Cfa間のPTS反応のSDS-PAGE結果氏-IgG-ΔSおよびFab-CfaN。 (D)アニオン交換カラムの溶出画分(E1およびE2)のSDS-PAGE結果。 Cfa間のPTS反応の反応混合物氏-IgG-ΔSおよびFab-CfaN 列に適用されました。 E1およびE2:溶出画分、M:分子量メーカー。 赤い矢印は、連結された製品(VH-CH1-H-チェーン)のバンドを示します。 青い矢印は、CfaのC末端側で制御されていない切断によって生成された重鎖を示します。氏。
したがって、我々は、VHH-Cfaと呼ばれるグリコシル化部位のSer欠失突然変異の発現ベクターを構築した。氏-Hchain-ΔS(図3a)。 Cfaを表現して精製した。氏-Cfaと同様にIgG-ΔS(抗CD3)氏-IgG(図3b)。 SDS-PAGEはCfa氏-IgG-ΔSは、非還元条件下で単一バンドでプロテインAカラム精製後に精製した(図3b;182.4kDa)。
その後、Cfa間のPTS反応を行った。氏-IgG-ΔSおよびFab-CfaN (図3c)。 PTS反応中の還元剤TCEP(Tris(2-Carboxyethyl)ホスフィン)の濃度効果は、1mMおよび10mM TCEP条件を実施して評価した(図3c)。 両TCEP条件は反応収率に大きな差がないことを示した。 セリン欠失変異体(Cfa)の使用氏-IgG-ΔS)は、制御されていない切断の副反応生成物の減少および元のCfaと比較して結紮収率の改善を示した。氏-IgGとFab-CfaN 反応。 Cfaに対する反応化学量論を1:2に設定したが、氏-IgG-ΔSおよびFab-CfaNFab-CfaのバンドN Cfa用バンドがライゲーション反応後に残っている間氏-H-鎖は大部分がライゲーション生成物であるVH-CH1-H-鎖に変換されます(図3c)。 ライゲーション反応後にFab-CfaNの反応物が残留する理由は、UVを用いた濃度測定の不正確さのため、CfaC-IgG-ΔSと比較してFab-CfaNの量が過剰である可能性があると推測した。 反応混合物をNi-NTAカラムに適用して未反応のFab-Cfaを除去した。N 次に灌流フラクションをアニオン交換クロマトグラフィーカラムに適用した。 SDS-PAGEは、微量の切断された副産物を有する精製された標的bsAb分子を示した(図3d)。 その後、我々はΔS変異を有する標的bsAb分子をIgG-Fabと命名した。2(Her2/CD3)。
IgG-Fabの結合活性2(Her2/CD3)
構築されたIgG-Fabの結合活性2(Her2/CD3)が評価されました。 まず、我々はIgG-Fabを観察した。2 蛍光顕微鏡でHer2陽性細胞に結合する(図4a)。 bsAbを添加しなかった蛍光顕微鏡画像と比較して、bsAbを処理した試料については、細胞表面から鮮明な蛍光が得られた。 蛍光はFITC標識抗Fc抗体から放出され、抗Her2 Fab部分はIgG-FabのN末端側を見つける。2。 したがって、蛍光画像は、Her2抗原に対する結合活性、ならびにFab(Her2)-Fab(CD3)-Fc構造の正しい構造形成を示す(図1、4a)。 次に、Her2陽性細胞およびCD3陽性細胞およびIgG-Fabを用いてフローサイトメトリーにより結合活性を評価した。2(Her2 / CD3)bsAbは両方の細胞に対する結合活性を示した(図4b)。 これらの結果は、IgG-Fabの結合活性を示す。2(Her2 / CD3)をHer2とCD3に向けます。
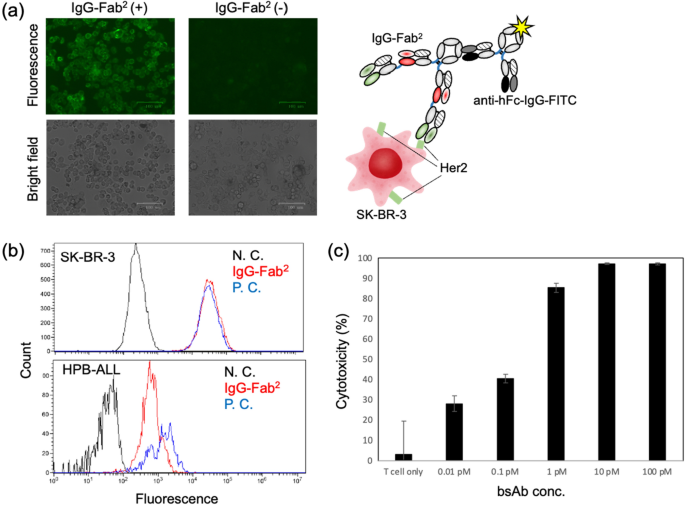
(ㅏ)SK-BR-3細胞の蛍光顕微鏡画像。 トップパネル:蛍光画像。 下部パネル:蛍光画像と同じ観察領域の明視野画像。 図は100μmのスケールバーを示す。 蛍光イメージングのための抗体の組み合わせは右に説明されています。 (雨)Her2陽性(SK-BR-3)またはCD3陽性(HPB-ALL)細胞を用いたフローサイトメトリー。 黒:陰性対照(抗体なし)。 青:抗Her2または抗CD3抗体を用いた陽性対照。 赤: IgG–Fab2。 (氏)in vitro細胞毒性アッセイ。 標的細胞:Her2+ SK-BR-3セル。 エフェクター細胞:LAK T細胞。 E / T比率= 5.決定された細胞毒性値の標準偏差は、エラーバーとして表示されます(n = 4)。
IgG-Fabの細胞傷害活性2活性化T細胞によって媒介される(Her2/CD3)
in vitro細胞傷害性アッセイにより、IgG-Fabの癌細胞死活性を測定した。2(Her2 / CD3)活性化T細胞(T細胞表現型を有するリンパ球活性化キラー細胞)によって媒介される [T-LAK])。 Her2陽性SK-BR-3細胞を、他のIgG-Fabを含む活性化T細胞と共にインキュベートした。2(Her2 / CD3)濃度(図4c)。 エフェクター細胞/標的細胞(E/T)比は5に設定されています。 1pM濃度のbsAbで80%以上のアポトーシスが観察された。 これは設定されたIgG-Fab2(Her2 / CD3)分子は、Her2とCD3抗原の結合を介してSK-BR-3細胞と活性化T細胞を同時に連結します。 Her2/CD3抗体はサイトカイン産生を通じてT細胞活性化を誘導することが知られており、IgG-Fabによっても同様のメカニズムが誘導されると予想しています。2(Her2 / CD3)細胞傷害性実験で。














+ There are no comments
Add yours