米国Alphabet傘下AI企業DeepMind 30日、タンパク質構造予測の重要な指標で定期的に開催されるコンペティション「Critical Assessment of protein Structure Prediction(CASP)」で、そのAI “AlphaFold」が参加して、原子レベルの誤差しかない高いスコアを達成したと発表した。 コンピューティングによる予測精度の高い特殊な手段に匹敵するものでされた歴史的な業績報道されており、今後、様々な病気機序の解明、新薬開発や産業廃棄物の削減などの分野で大きく貢献するものと期待される。
「原子レベルの誤差しかない」構造予測をコンピュータで初めて達成
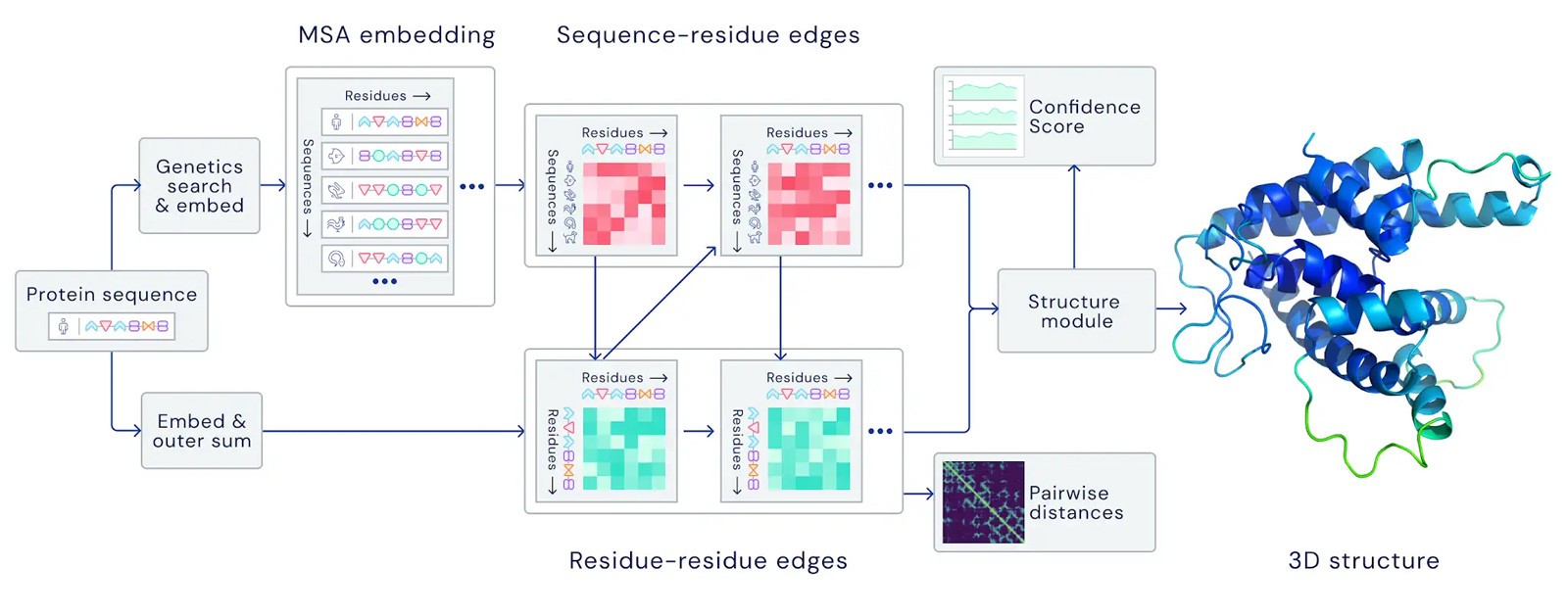
ほとんどの生命活動を維持するために不可欠なタンパク質は、アミノ酸の鎖で構成された大規模で複雑な分子(高分子形)ですそれぞれ独特の立体構造を構成している。 この構造は、そのタンパク質の機能を決定し、すなわち構造を予測し、分析することこそタンパク質が関与して、ほぼすべての疾患機序の解明、さらには治療の候補物質(これもタンパク質である場合が多い)を発見、新薬の開発にもつながっていく。ニュークレア製の研究でアミノ酸配列がタンパク質の構造を決定していることを予言した安徽千賀ノーベル生化学賞を受賞した1972年から、各タンパク質がどのように立体構造を構成していくのか(縮小されていくのか)を解明することが「タンパク質の折り畳み問題(=タンパク質折り畳みの問題)」で言って、過去50年の生物学に一大テーマとなっている。
この課題の克服のために、「低温電子顕微鏡法」や「核磁気共鳴法」と呼ばれる特殊または大規模な設備を活用した構造解析法が開発されてきているが、日本円にすると数億円の専用装備であり、もう一つの構造を分析するためには数年かかるのが普通であった。20世紀後半に入って計算速度・精度の両方飛躍的に高まったコンピュータを利用した構造解析が盛んになったことにより、その解析モデルの評価を行うために始まったものでCASPある。CASPは、1994年から2年ごとに開催される世界の研究グループに分析するためのさまざまな3D構造モデルを提供することで、予測方法を客観的にテストすることができる機会を提供している。DeepMindこの分析にチャレンジするAIを縮小問題ちなみ “AlphaFold」と命名2018年から参加してきた。 最近終了したCASP14は、数週間に渡って、約17万解明されたタンパク質の配列や形状を含む公開データベースアルゴリズムを教育し、取り組んだが、これは他の研究と比較すると、定量的に減らして同じものである。
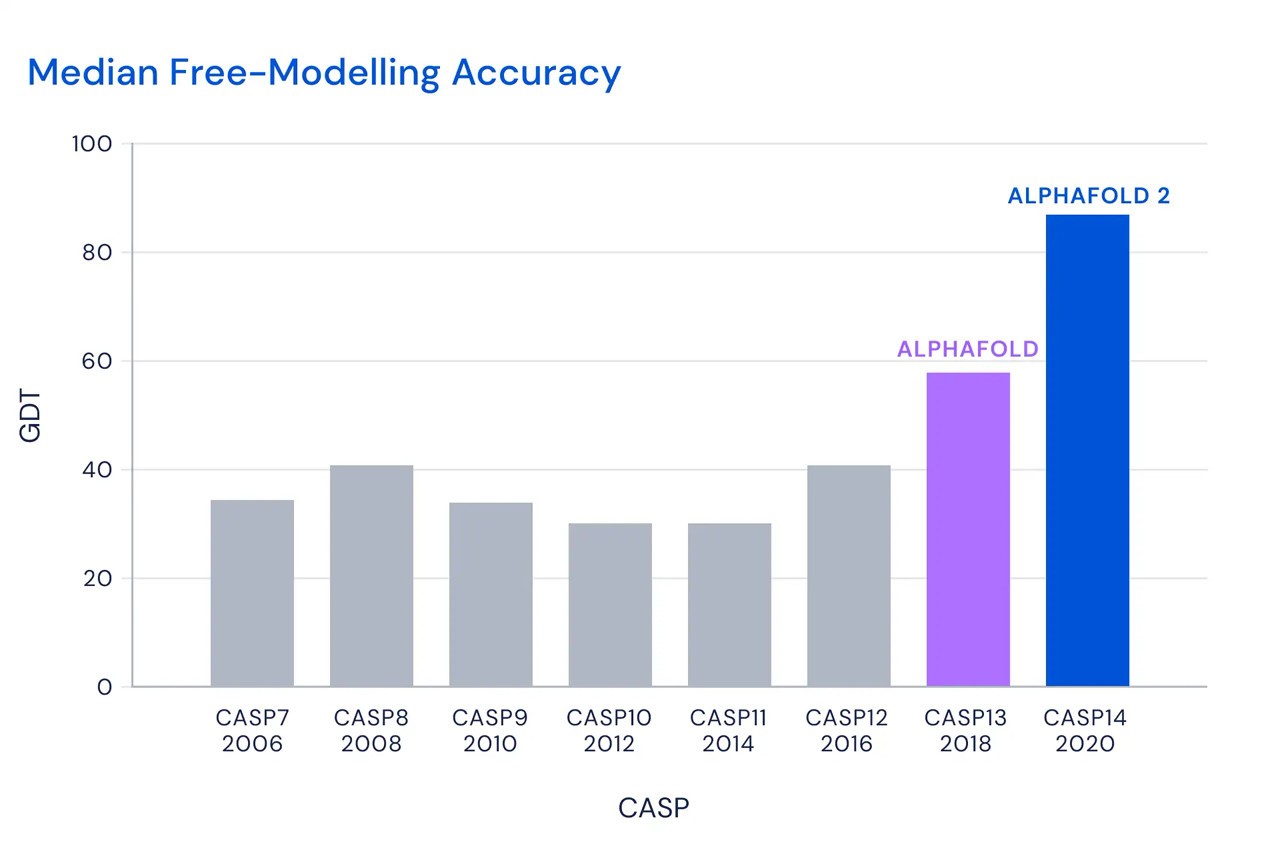
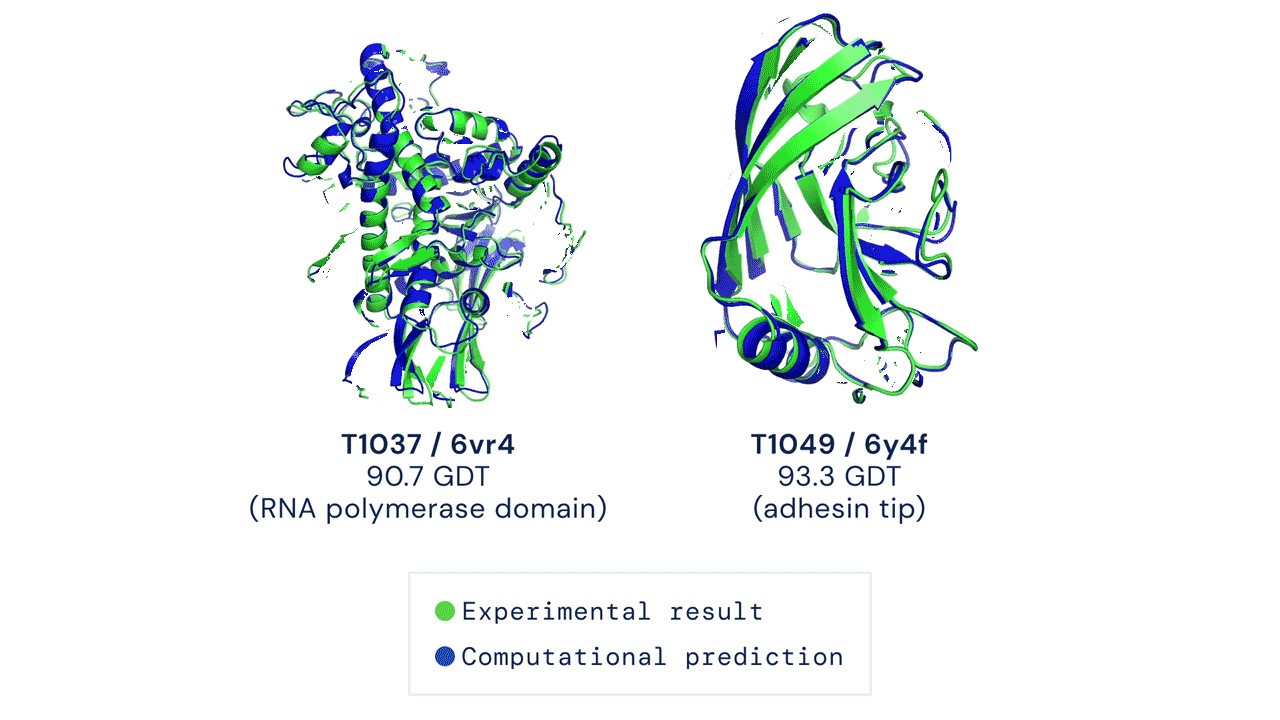
そして30日に発表された結果は、参加した中で最高のものであっただけでなく、予測の平均誤差が約1.6 オングストロームしかなかった歴史的な性能であった。 オングストロームという単位自体が原子や分子レベルの小ささを示すものであり、その単位で1.6の数値しかなかったのは、すなわち、誤差が原子レベルだったことを示している。 そして、この数値は、分析のための蛋白質などを実際に生成する実験とほぼ同じレベルの分析は、コンピュータ上で行うことができようになった歴史的な節目となった。
また、この結果は、今後のコンピュータで構造予測をすることがなく、研究のメインストリームになることを強く示唆していることでもある。 イランは最近、新薬開発の分野で注目されている「ナノマシン」と呼ばれるような分子レベルでの薬の原料などを行うことにより、薬剤療法の効用を高くしたり、副作用を減少させようとする構造の進展が現在の分析方法の限界に詰まっているからである。ナノマシンの研究は、分子ゲートキーパーとして立ちはだかる “膜タンパク質」の研究が不可欠であるが、この膜タンパク質は、実験モデルを作成することは非常に困難物質である。 実際CASP14運営側でAlphaFoldの性能を評価マックスプランク発生生物学研究所のアンドレイルーパス教授は「AlphaFoldの驚くべき正確なモデルは、10年近く付す蛋白質の構造解明しようと再び動き出し物質が細胞膜を越えてどのように伝播されるかを解明することができるだろう」と述べた。
AlphaFoldプロジェクトチームは、CASP14に臨むにおいて開発されたアルゴリズムを審査された論文で発表し、世界的に利用できるようにすることを目標にすると表明している。










![ロマングロージャン「子供のためにも死ぬことはなかった」/ F1バーレーンGPの大炎上衝突で奇跡の生還[F1-Gate.com] ロマングロージャン「子供のためにも死ぬことはなかった」/ F1バーレーンGPの大炎上衝突で奇跡の生還[F1-Gate.com]](https://f1-gate.com/media/img2020/20201202-romain-grosjean-f1.jpg)


+ There are no comments
Add yours