ヒトiPSC文化
hiPSCに関するすべての実験は関西医科大学倫理委員会によって承認されました(承認番号:2020197)。 私たちは、hiPSCが派生したドナーの書面による同意を得ました。 本研究は、2013年に改正されたヘルシンキ宣言の原則と関連する制度的指針に従って行われた。 ヒトiPSC(585A1、253G1およびHiPS-RIKEN-2F)は、iMatrix-511シルク(892021、892021、日本大阪マトリックスソーム)、5%COで37℃2 ブランギ。 その後の継代および足細胞分化誘導のために、Accutase(AT104、Innovative cell Technologies、CA、USA)を用いて、hiPSCコロニー(70〜90%コンフルエント)から単一細胞を調製した。
ネフロン前駆細胞を介したhiPSCからの足細胞分化
我々は以前に報告された分化プロトコルを修正してhiPSCから足細胞を生成した。16 (図1A)。 ヒトiPSCを、96ウェル低細胞結合V-底プレートにウェル当たり3000個の細胞で播種し、10μM Y27632(FCS-10-2301-25、Focus biomolecules、PA、USA)を含む200μL NutriStem培地で培養した。 37℃で24時間。 培地を2%B27サプリメント(17504044、Thermo Fisher Scientific、MA、USA)、1ng/mLヒトアクチビンA(338-AC、R&D Systems、MN、USA)および20ng/mL線維芽細胞成長因子2(FGF2、 064-04541、Fujifilm)。 24時間後、細胞凝集体を2%B27サプリメントと2日毎に交換した10μM CHIR99021(10−1279、Focus biomolecules)を含む培地(DMEM Ham’s/F12培地)中で6日間インキュベートした。 次いで、培地を、10ng/mLヒトアクチビンA、3ng/mLヒト骨形成タンパク質4(BMP4、PROTP12644、R&D System)、3μM CHIR99021および100nMレチノイン酸(RA、302-79)を含む培地と交換した。 -4、富士フイルム)。 さらに72時間後、この培地を培地交換なしで1μM CHIR99021および10ng/mL FGF9(273-F9、R&D Systems)を含む培地と交換してNPCの分化を誘導した。
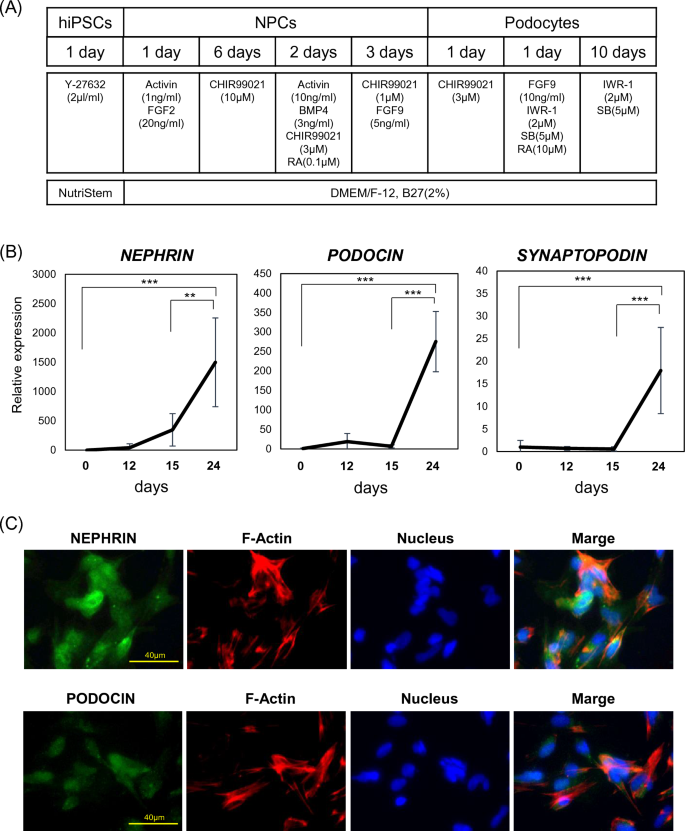
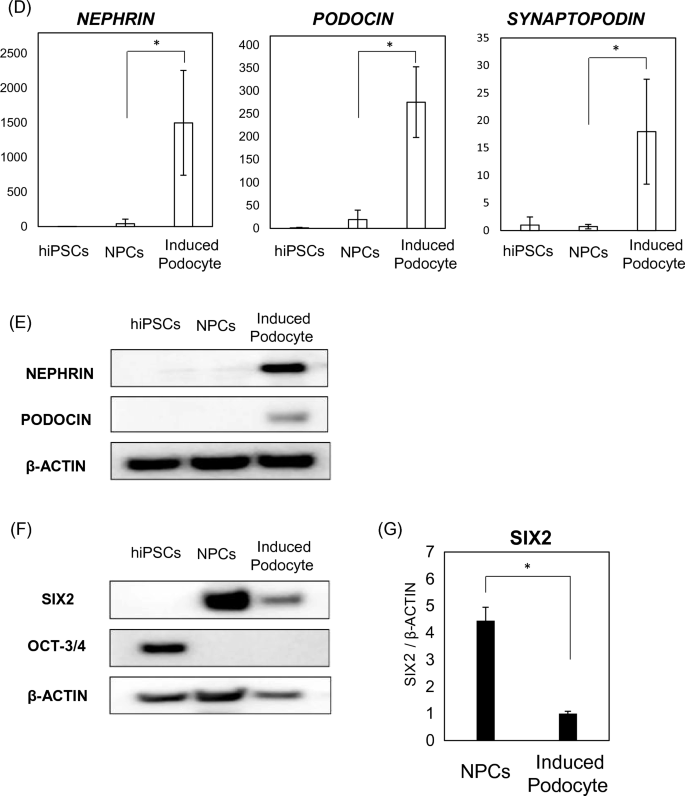
hiPSC を足細胞に分化させます。 (ㅏ)hiPSCの足細胞への分化に関与するタイムラインと要因。 (雨) 有足細胞関連遺伝子の mRNA 発現 (ネフリン、 ブドウシンそして シナプトポジン)24日間の潜伏期間中。 結果は、6つのサンプルの平均±SDで表されます。 統計分析は、ボンフェローニ試験と組み合わせた一元分散分析を用いて行った。 **p < 0.01、***p < 0.001。 (氏)Hoechst染色核を用いて分化した細胞における足細胞(NEPHRINおよびPODOCIN)およびF-アクチンのマーカーに対する免疫染色。 (d)hiPSC、NPC、および分化した足細胞における足細胞関連遺伝子(NEPHRIN、PODOCIN、およびSYNAPTOPODIN)のmRNA発現。 結果は、6 つのサンプルの平均値 ± SD として表されます。 統計分析は、ボンフェローニ検定による一元配置分散分析を使用して実行されました。 *p < 0.05 (金利)ウエスタンブロット分析を用いて評価したhiPSC、NPCおよび分化足細胞におけるネフリンおよびポドシンのタンパク質発現。 (F)hiPSC、NPC、および分化足細胞における未分化幹細胞マーカー(OCT-3/4)およびネフロン前駆細胞マーカー(SIX2)のタンパク質発現、ウェスタンブロッティング分析を使用して評価した。 (G)ウエスタンブロット分析を用いて評価したネフロン前駆細胞マーカー(SIX2)のタンパク質発現。 結果は、3つのサンプルの平均±SDで表されます。 スチューデントtテストを使用して統計的有意性を評価しました。 *p < 0.05。
有足細胞を生成するために、培地を 3 μM CHIR99021 を含む培地に切り替え、24 時間後に 2 μM IWR-1 (1127442-82-3、Fujifilm)、5 μM SB431542 (13031、Cayman Chemical、MI、USA) を含む細胞に切り替えました。 . バッジに切り替えました。 )および10μM RA。 さらに24時間後、分化した細胞を2μM IWR-1および5μM SB431542を含む新鮮な培地で11日間培養し、3日ごとに交換した。 どの段階でも細胞の選別は行われませんでした。
単層細胞培養物を構築するために、細胞凝集体を50mL遠心分離管に移し、PBSで洗浄し、次にアキュターゼを用いて解離した。 セル (2,000 セル/cm2)をiMatrix-511シルクコーティング皿に振りかけ、10μM Y27632および2%B27サプリメントを補充したDMEM Ham’s / F12培地で培養した。 Y27632およびB27サプリメントを添加したDMEMハム/F12培地での処理の24時間後に細胞を収集した。
足細胞分化におけるmTOR経路の関連性を評価するために、ラパマイシン(R0161、LKT Laboratories、MN、USA)を分化過程の様々な時点で投与し、RT-PCRを用いてmRNA発現を評価した。 さらに、mTOR 経路への関与をさらに評価するために、LY2584702 を使用して mTOR の下流の S6 を阻害しました。
RT-PCR
ISOGEN II試薬(311-07361、日本遺伝子、東京、日本)を用いて細胞からRNAを抽出した後、ReverTra Ace qPCR RT Master Mix(FSQ-201、東洋紡、日本、日本)を用いて逆転写を行った。 Rotor-Gene Q(Qiagen)およびThunderbird SYBR qPCR Mix(QPS-201, Toyobo)を用いて、標的mRNA発現を定量するためにリアルタイムPCRを行った。 使用した特定の PCR プライマーを列挙します (表 1)。
ウェスタンブロッティング
4×Bolt LDSサンプル緩衝液(B0007、Thermo Fisher Scientific)を使用して細胞溶解物を収集し、10%SDSポリアクリルアミドゲルで電気泳動し、PVDF膜にブロットした。 膜を抗NEPHRIN (29070、Immuno-Biological Laboratories、群馬、日本)、抗PODOCIN (MBS9608910、Thermo Fisher Scientific)、抗Phospho-Akt (9271、Cell Signaling Technology、MA、USA)、抗PODOCIN (MBS9608910)、Thermo Fisher Scientific)。 -Akt (9272、Cell Signaling Technology)、anti-Phospho-mTOR (2971、Cell Signaling Technology)、anti-mTOR (2972、Cell Signaling Technology)、anti-Phospho-p70 S6 キナーゼ (9205、Cell Signaling Technology)、抗-mTOR -p70 S6 キナーゼ (2708、Cell Signaling Technology)、抗リン酸 S6 リボソームタンパク質 (2211、Cell Signaling Technology)、S6 リボソームタンパク質 (2217、Cell Signaling Technology)、抗 SIX2 (80170、Cell Signaling Technology) )、抗OCT3/4(611202、BD Biosciences、ニュージャージー州、米国)および抗βアクチン(MAB8929、R&D Systems)一次抗体とそれに続く抗マウスIgGホースラディッシュペルオキシダーゼコンジュゲーション(A90-131P、ベチルラボラトリーズ、テキサス州)さらに調査します。 、米国)二次抗体。 Pierce Western Blotting Substrate (NCI3106、Thermo Fisher Scientific) を使用して、特定のタンパク質バンドを視覚化しました。
フローサイトメトリー
Accutaseを用いて単離した後、培養細胞を回収し、1:20に希釈したFITC結合抗PODOCIN抗体と共に4℃で30分間インキュベートした。 次に細胞を遠心分離し、上清を除去し、2%StemSure Serum replacement(191-18375、Fujifilm)を含むPBS 500μLアリコートを加えた。 データは、BD FACS Canto II フローサイトメトリー システム (BD Biosciences) を使用して取得されました。
免疫染色
細胞を4%パラホルムアルデヒドを用いて固定し、室温で60分間Blocking One(03953-95、Nacalai Tesque、日本京都)でブロックした。 次いで、一次抗NEPHRIN、抗PODOCIN抗体およびF-Actin(bs-1571R、Bioss Inc.、MA、USA)抗体を用いて4℃で一晩インキュベートした。 次に、Alexa Fluor 488 タグ付き二次抗体 (ab150107、Abcam、ケンブリッジ、英国) を室温で 30 分間適用し、続いて 10 μg/mL Hoechst 33342 (346-07951、DOJINDO Laboratories、熊本、日本) および Phalloidin-iFluor 647 を適用しました。コンジュゲート(23127、AAT Bioquest、カリフォルニア州、米国)。 染色された細胞は、蛍光顕微鏡 (BZ-X810、Keyence、大阪、日本) を使用して評価されました。
透過性解析
hiPSCから分化した足細胞を2000細胞/cm で播種した。2 iMatrix-511シルクでコーティングされた細孔サイズ0.4μm(3450、Corning、AZ、USA)の6ウェル培養プレートにTranswellインサートを挿入します。 24 時間後、2% B27 サプリメント、塩化カリウム (5 mM)、尿素 (25 mg/L) およびヒト血清アルブミン (3 g/dL) を含む DMEM Ham’s/F12 培地を下部チャンバーに添加し、細胞を上部チャンバーで増殖させました。後の 3 つの物質は、それらを含まない培地で培養されました。 24時間後、両方のチャンバーから培地を収集した。 カリウム濃度は、カリウム測定試薬および電極(EA09、A&T Corporation、神奈川県)を使用して測定しました。 尿素窒素とアルブミンは自動分析装置(JCA-BM8020、日本電子株式会社、東京、日本)を使用して分析されました。
統計分析
データは平均値 ± 標準偏差 (SD) として表されます。 すべての実験は 3 回の独立した実験で実行されました。 図に示す結果については、 図1B、2A、および3Bでは、一元分散分析を使用して統計分析を行った後、Bonferroniテストを行いました。 図1と2に示すデータについて、2つのグループの平均値を比較するためにスチューデントtテストを実行しました。 2Cと5B。 <0.05 の p 値は統計的有意性を示すとみなされました。
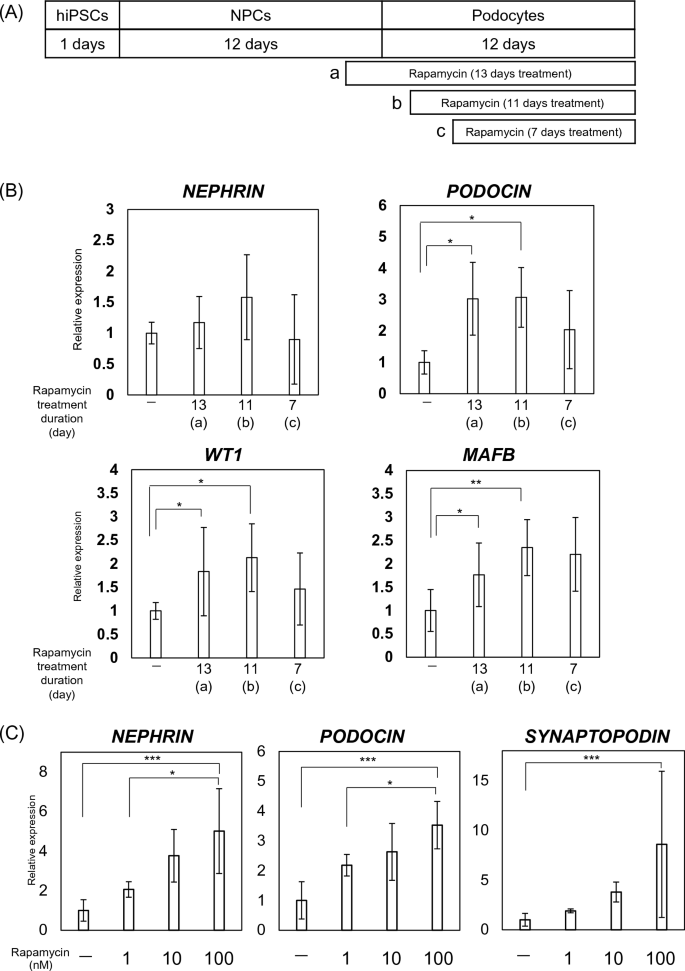
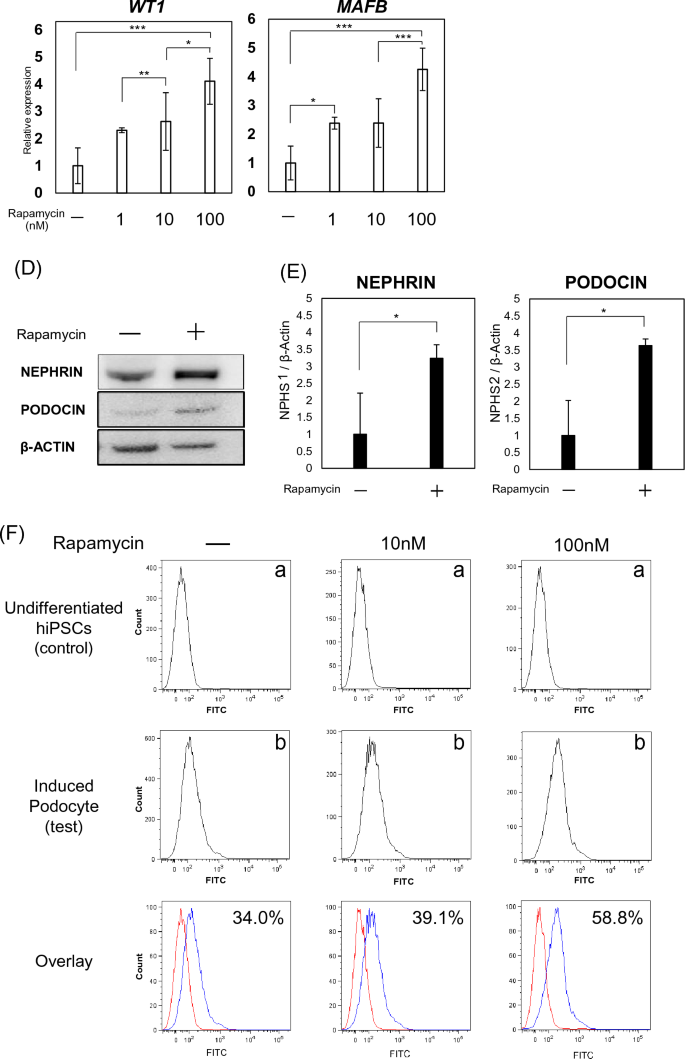
有足細胞の分化に対する mTOR 阻害剤の影響。 (全て) プロトコール改善のためのラパマイシン投与タイミングの評価: (a) 13 日間の治療、(b) 11 日間の治療、(c) 7 日間の治療。 (雨)様々な時間に100 nMラパマイシンで処理された細胞における足細胞関連遺伝子(NEPHRIN、PODOCIN、WT1およびMAFB)のmRNA発現(a、b、c)。 結果は、6 つのサンプルの平均値 ± SD として表されます。 統計分析は、ボンフェローニ検定による一元配置分散分析を使用して実行されました。 *p < 0.05、**p < 0.01。 (シード) 有足細胞関連遺伝子の mRNA 発現 (ネフリン、 グレープサイン、 シナプトポディン、 WT1そして MAFB) さまざまな濃度のラパマイシンで処理した細胞。 結果は、6 つのサンプルの平均値 ± SD として表されます。 統計分析は、ボンフェローニ検定による一元配置分散分析を使用して実行されました。 *p < 0.05、**p < 0.01、***p < 0.001。 (d) ウェスタンブロット分析を使用して評価した、分化した有足細胞におけるネフリンおよびポドシンのタンパク質発現。 (E) ウェスタンブロット分析を使用して評価されたネフリンおよびポドシンのタンパク質発現。 結果は、3 つのサンプルの平均値 ± SD として表されます。 統計的有意性は、スチューデントの t 検定を使用して評価されました。 * p <0.05。 (F)FACSを使用して定量化されたポドシン陽性細胞のヒストグラム:(a)未分化hiPSCおよび(b)hiPSCから分化した足細胞。
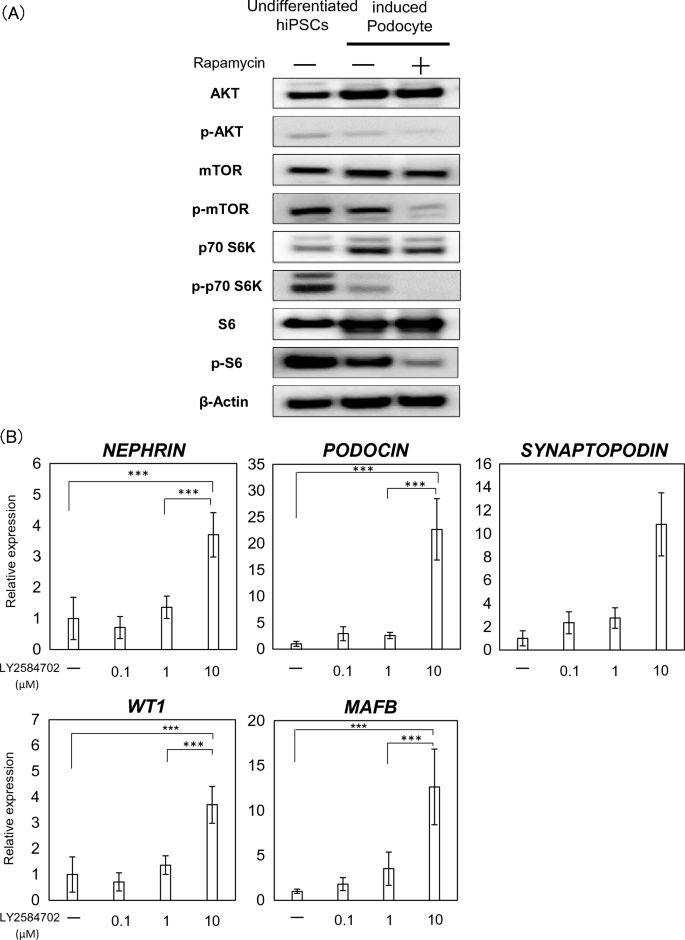
有足細胞の分化における mTOR 経路の重要性。 (全て) ウェスタンブロット分析を使用して評価した、mTOR、p-mTOR、p70 S6K、p-p70 S6K、S6、p-S6、AKT、および p-AKT のタンパク質発現。 (雨) 有足細胞関連遺伝子の mRNA 発現 (ネフリン、 グレープサイン、 シナプトポジン、 WT1そして MAFB) S6 阻害剤 LY2584702 の添加後。 結果は、6 つのサンプルの平均値 ± SD として表されます。 統計分析は、ボンフェローニ検定による一元配置分散分析を使用して実行されました。 ***p<0.001。















+ There are no comments
Add yours